A
Size: a a a
2020 September 11
Народ все миксует и платит годами "товарные" кустищи
В
A
Ратит*
A
Заебал етот т9
A
Тут не исправил😂
В
Alex
Заебал етот т9
читаю, подумал пятница, а тут оказывается т9 ))))
A
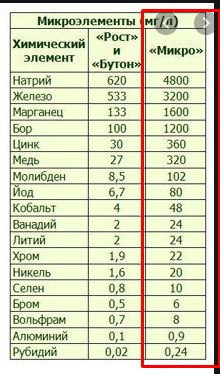
Натрий, это то чего вечно не хватает растишкам, остро и постоянно
В
Alex
Натрий, это то чего вечно не хватает растишкам, остро и постоянно
так натрий от того, что там хелаты
A
Прям как гумата натрия нам, постоянная нехватка
В
ща за фотаю бутыль
В
Васек
ща за фотаю бутыль
короче забалаболил я у меня не унифлор (он уже закончился давно, а в голове остался) Аквамикс БХЗ ))))
В
Хорошо попер и посмотрел на бутыль))
A
А я говорил аквамикс
В
Alex
А я говорил аквамикс
бывает, старость не радость)))
A
Акварин хвойный + селитра кальциевая + акварин = чюдо юдо смесь
В
Alex
Акварин хвойный + селитра кальциевая + акварин = чюдо юдо смесь
для домохозяек и домохозяев 100% )))
A
Чат можно закрывать, Серёгин калк тоже все уже сделано найдено универсальное средство, завтра разорятся все тепличные комбинаты и все непродвинутые юзеры не познавшие дзен ах+ск😂🙈
В
Alex
Чат можно закрывать, Серёгин калк тоже все уже сделано найдено универсальное средство, завтра разорятся все тепличные комбинаты и все непродвинутые юзеры не познавшие дзен ах+ск😂🙈
не, кто познает дзен гидропонике и перейдёт на следующий уровень, тем обязательно нужен будет калк и еще маленькая лаборатория в комплекте с агрономом)
A
А кто то по старинке в столбик, как пример "древности":
Расчёт можно вести в мМоль/л, а можно и мг/л. Так как состав пит. раствора в мг/л, то проще и расчёт делать в мг/л.
Азотки внесли 3,2 мМоль/л. Значит с ней внесли азота NO3 = 3,2*14 = 44,8 мг/л.
Магний не добавляем. В исходной воде 80 мг/л.
Считаем Са.
В воде 160 мг/л, нужно - 220, осталось внести 220-160 = 60 мг/л.
Чтобы внести 60 мг Са нужно Кальцинита 60*100/19 = 315,8 мг.
Это тянет за собой N-NO3 = 315,6*14,4/100 = 45,5 мг
и N-NH4 = 315,6*1,1/100 = 3,5 мг.
Считаем N-NH4.
Нужно в растворе 15 мг/л, внесли с кальцинитом 3,5 мг, осталось внести 15-3,5 = 11,5 мг/л.
Нужно амиачки 11,5*100/17,2 = 66,9 мг.
Это тянет столько же N-NO3 = 11,5 мг.
Считаем Р.
Нужно внести 75*100/22,9 = 327,5 мг.
Это тянет за собой 327,5*28,2/100 = 92,4 мг калия.
Считаем К.
Нужно в р-ре 275 мг/л, внесли с KH2PO4 92,4 мг, осталось внести 275-92,4 = 182,6 мг.
182,6*100/38,2 = 478 мг KNO3.
Это тянет за собой N-NO3 478*13,6/100 = 65 мг.
Считаем сколько внесено N-NO3 с азоткой, с Кальцинитом, с амиачкой и с KNO3.
44,8+45,5+11,5+65 = 166,8 мг/л.
А требуется 235 мг. Не хватает 235-166,8 = 68,2 мг/л.
Это нормально при таком содержании серы в воде. Если требуется поднять азот, то можно увеличить дозу Кальцинита на 5-15 %, или добавить нитрат магния, или амиачную селитру.
Распределение по бакам.
Бак Б. Масса удобрений на 1 л маточного р-ра при разбавлении 1/100.
KH2PO4 327.5 *100 = 32750 мг = 32,75 г.
NH4NO3 66,9 *100 = 6690 мг = 6,69 г.
Масса всего 32,75 + 6,69 = 39,44 г.
Бак А.
Кальцинит 315,8 *100 = 31580 мг/л = 31,58 г/л.
Разность по бакам 39,44-31,58 = 7,86 г уравниваем KNO3.
Нужно всего внести 47,8 г KNO3. Из них 7,86 г сыпем в бак А - теперь в баках поровну, а остальные 47,8-7,86 = 40 г делим поровну (по 20 г), и сыпем в бак А и Б.
Можно амиачку положить в бак А, а KNO3 также уравнять физ. вес по бакам.
Катионы/анионы уравнивать не нужно.
Растворение указанного количества солей поднимет ЕС примерно на 1,4 мСМ/см.
ЕС пит. раствора составит 3,6-3,8 мСм/см.
Расчёт можно вести в мМоль/л, а можно и мг/л. Так как состав пит. раствора в мг/л, то проще и расчёт делать в мг/л.
Азотки внесли 3,2 мМоль/л. Значит с ней внесли азота NO3 = 3,2*14 = 44,8 мг/л.
Магний не добавляем. В исходной воде 80 мг/л.
Считаем Са.
В воде 160 мг/л, нужно - 220, осталось внести 220-160 = 60 мг/л.
Чтобы внести 60 мг Са нужно Кальцинита 60*100/19 = 315,8 мг.
Это тянет за собой N-NO3 = 315,6*14,4/100 = 45,5 мг
и N-NH4 = 315,6*1,1/100 = 3,5 мг.
Считаем N-NH4.
Нужно в растворе 15 мг/л, внесли с кальцинитом 3,5 мг, осталось внести 15-3,5 = 11,5 мг/л.
Нужно амиачки 11,5*100/17,2 = 66,9 мг.
Это тянет столько же N-NO3 = 11,5 мг.
Считаем Р.
Нужно внести 75*100/22,9 = 327,5 мг.
Это тянет за собой 327,5*28,2/100 = 92,4 мг калия.
Считаем К.
Нужно в р-ре 275 мг/л, внесли с KH2PO4 92,4 мг, осталось внести 275-92,4 = 182,6 мг.
182,6*100/38,2 = 478 мг KNO3.
Это тянет за собой N-NO3 478*13,6/100 = 65 мг.
Считаем сколько внесено N-NO3 с азоткой, с Кальцинитом, с амиачкой и с KNO3.
44,8+45,5+11,5+65 = 166,8 мг/л.
А требуется 235 мг. Не хватает 235-166,8 = 68,2 мг/л.
Это нормально при таком содержании серы в воде. Если требуется поднять азот, то можно увеличить дозу Кальцинита на 5-15 %, или добавить нитрат магния, или амиачную селитру.
Распределение по бакам.
Бак Б. Масса удобрений на 1 л маточного р-ра при разбавлении 1/100.
KH2PO4 327.5 *100 = 32750 мг = 32,75 г.
NH4NO3 66,9 *100 = 6690 мг = 6,69 г.
Масса всего 32,75 + 6,69 = 39,44 г.
Бак А.
Кальцинит 315,8 *100 = 31580 мг/л = 31,58 г/л.
Разность по бакам 39,44-31,58 = 7,86 г уравниваем KNO3.
Нужно всего внести 47,8 г KNO3. Из них 7,86 г сыпем в бак А - теперь в баках поровну, а остальные 47,8-7,86 = 40 г делим поровну (по 20 г), и сыпем в бак А и Б.
Можно амиачку положить в бак А, а KNO3 также уравнять физ. вес по бакам.
Катионы/анионы уравнивать не нужно.
Растворение указанного количества солей поднимет ЕС примерно на 1,4 мСМ/см.
ЕС пит. раствора составит 3,6-3,8 мСм/см.
В
Alex
А кто то по старинке в столбик, как пример "древности":
Расчёт можно вести в мМоль/л, а можно и мг/л. Так как состав пит. раствора в мг/л, то проще и расчёт делать в мг/л.
Азотки внесли 3,2 мМоль/л. Значит с ней внесли азота NO3 = 3,2*14 = 44,8 мг/л.
Магний не добавляем. В исходной воде 80 мг/л.
Считаем Са.
В воде 160 мг/л, нужно - 220, осталось внести 220-160 = 60 мг/л.
Чтобы внести 60 мг Са нужно Кальцинита 60*100/19 = 315,8 мг.
Это тянет за собой N-NO3 = 315,6*14,4/100 = 45,5 мг
и N-NH4 = 315,6*1,1/100 = 3,5 мг.
Считаем N-NH4.
Нужно в растворе 15 мг/л, внесли с кальцинитом 3,5 мг, осталось внести 15-3,5 = 11,5 мг/л.
Нужно амиачки 11,5*100/17,2 = 66,9 мг.
Это тянет столько же N-NO3 = 11,5 мг.
Считаем Р.
Нужно внести 75*100/22,9 = 327,5 мг.
Это тянет за собой 327,5*28,2/100 = 92,4 мг калия.
Считаем К.
Нужно в р-ре 275 мг/л, внесли с KH2PO4 92,4 мг, осталось внести 275-92,4 = 182,6 мг.
182,6*100/38,2 = 478 мг KNO3.
Это тянет за собой N-NO3 478*13,6/100 = 65 мг.
Считаем сколько внесено N-NO3 с азоткой, с Кальцинитом, с амиачкой и с KNO3.
44,8+45,5+11,5+65 = 166,8 мг/л.
А требуется 235 мг. Не хватает 235-166,8 = 68,2 мг/л.
Это нормально при таком содержании серы в воде. Если требуется поднять азот, то можно увеличить дозу Кальцинита на 5-15 %, или добавить нитрат магния, или амиачную селитру.
Распределение по бакам.
Бак Б. Масса удобрений на 1 л маточного р-ра при разбавлении 1/100.
KH2PO4 327.5 *100 = 32750 мг = 32,75 г.
NH4NO3 66,9 *100 = 6690 мг = 6,69 г.
Масса всего 32,75 + 6,69 = 39,44 г.
Бак А.
Кальцинит 315,8 *100 = 31580 мг/л = 31,58 г/л.
Разность по бакам 39,44-31,58 = 7,86 г уравниваем KNO3.
Нужно всего внести 47,8 г KNO3. Из них 7,86 г сыпем в бак А - теперь в баках поровну, а остальные 47,8-7,86 = 40 г делим поровну (по 20 г), и сыпем в бак А и Б.
Можно амиачку положить в бак А, а KNO3 также уравнять физ. вес по бакам.
Катионы/анионы уравнивать не нужно.
Растворение указанного количества солей поднимет ЕС примерно на 1,4 мСМ/см.
ЕС пит. раствора составит 3,6-3,8 мСм/см.
Расчёт можно вести в мМоль/л, а можно и мг/л. Так как состав пит. раствора в мг/л, то проще и расчёт делать в мг/л.
Азотки внесли 3,2 мМоль/л. Значит с ней внесли азота NO3 = 3,2*14 = 44,8 мг/л.
Магний не добавляем. В исходной воде 80 мг/л.
Считаем Са.
В воде 160 мг/л, нужно - 220, осталось внести 220-160 = 60 мг/л.
Чтобы внести 60 мг Са нужно Кальцинита 60*100/19 = 315,8 мг.
Это тянет за собой N-NO3 = 315,6*14,4/100 = 45,5 мг
и N-NH4 = 315,6*1,1/100 = 3,5 мг.
Считаем N-NH4.
Нужно в растворе 15 мг/л, внесли с кальцинитом 3,5 мг, осталось внести 15-3,5 = 11,5 мг/л.
Нужно амиачки 11,5*100/17,2 = 66,9 мг.
Это тянет столько же N-NO3 = 11,5 мг.
Считаем Р.
Нужно внести 75*100/22,9 = 327,5 мг.
Это тянет за собой 327,5*28,2/100 = 92,4 мг калия.
Считаем К.
Нужно в р-ре 275 мг/л, внесли с KH2PO4 92,4 мг, осталось внести 275-92,4 = 182,6 мг.
182,6*100/38,2 = 478 мг KNO3.
Это тянет за собой N-NO3 478*13,6/100 = 65 мг.
Считаем сколько внесено N-NO3 с азоткой, с Кальцинитом, с амиачкой и с KNO3.
44,8+45,5+11,5+65 = 166,8 мг/л.
А требуется 235 мг. Не хватает 235-166,8 = 68,2 мг/л.
Это нормально при таком содержании серы в воде. Если требуется поднять азот, то можно увеличить дозу Кальцинита на 5-15 %, или добавить нитрат магния, или амиачную селитру.
Распределение по бакам.
Бак Б. Масса удобрений на 1 л маточного р-ра при разбавлении 1/100.
KH2PO4 327.5 *100 = 32750 мг = 32,75 г.
NH4NO3 66,9 *100 = 6690 мг = 6,69 г.
Масса всего 32,75 + 6,69 = 39,44 г.
Бак А.
Кальцинит 315,8 *100 = 31580 мг/л = 31,58 г/л.
Разность по бакам 39,44-31,58 = 7,86 г уравниваем KNO3.
Нужно всего внести 47,8 г KNO3. Из них 7,86 г сыпем в бак А - теперь в баках поровну, а остальные 47,8-7,86 = 40 г делим поровну (по 20 г), и сыпем в бак А и Б.
Можно амиачку положить в бак А, а KNO3 также уравнять физ. вес по бакам.
Катионы/анионы уравнивать не нужно.
Растворение указанного количества солей поднимет ЕС примерно на 1,4 мСМ/см.
ЕС пит. раствора составит 3,6-3,8 мСм/см.
И это по старинке, в древности?))



