т
Size: a a a
2020 August 21
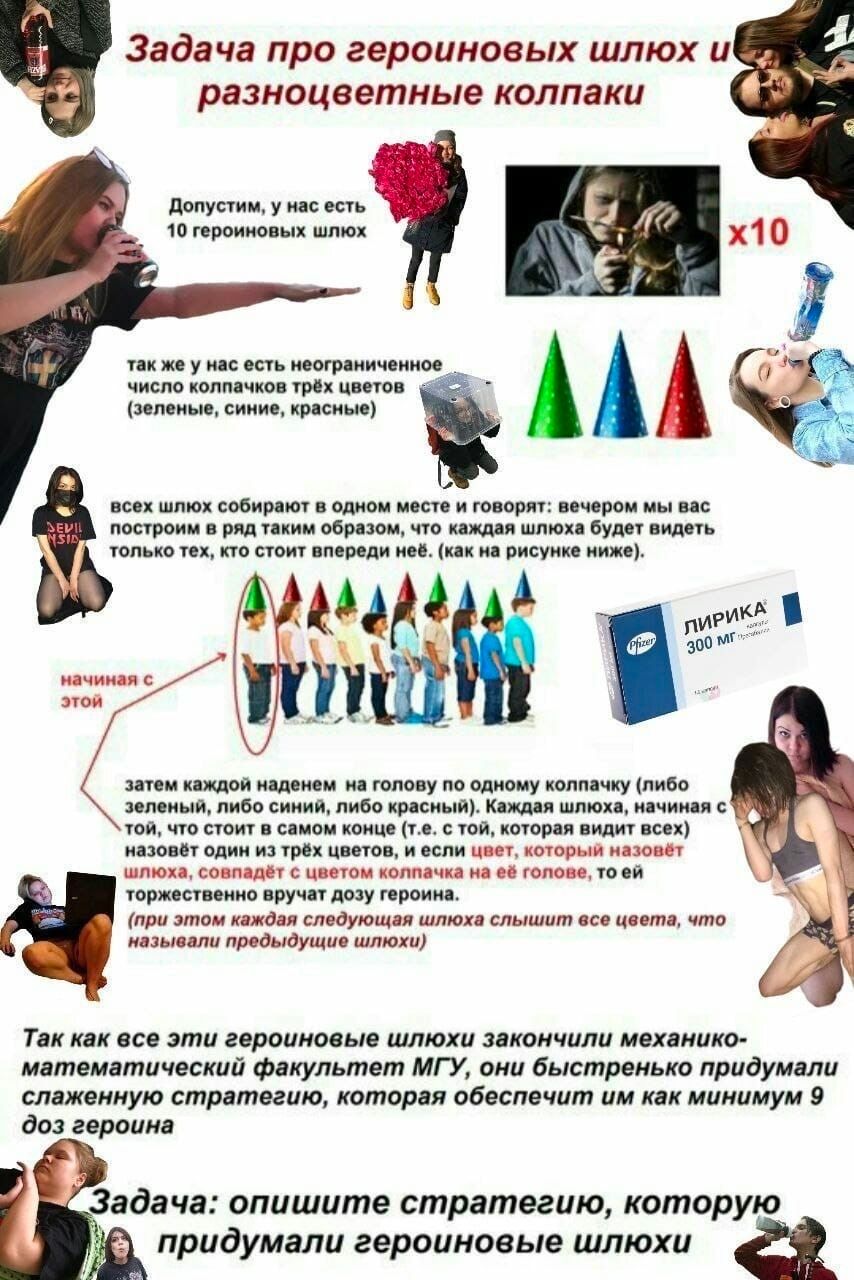
Верно, а условие выигрыша какое ?
минимум 9
DB
Назвать свой цвет
т
ну первая шлюха ошибется с 33% вероятностью, вторая, третья.... девятая и наконец десятая знают цвет своего колпака
т
Назвать свой цвет
так какимм сказали и получаем 9 доз героина
/¯
изи задачка, где получить свою дозу?
т
я понял ошибку
т
свою
А
Давай решение
А
Получишь дозу
т
Назвать свой цвет
а что если интонацию использовать типа спокойная-зелены, вопросительная - красный, восклицательная- синий?
А
Низя
А
То есть такой вариант не подразумевается условием задачи.
А
Это классическая задача со вступительных, но в такой итерации
/¯
кодируем колпачки: синий 0, зелёный 1, красный 2. Поддерживаем куммулятивную сумму в кольце F_3.
Первая героиновая шлюха, которая видим всех, называет сумму всех, кого видит. Следующая за ней видит сумму всех, кроме своей: отняла одно от другого, получила свой колпак.
Следующая за ней это тоже услышала, скорректировала. И тд
Первая героиновая шлюха, которая видим всех, называет сумму всех, кого видит. Следующая за ней видит сумму всех, кроме своей: отняла одно от другого, получила свой колпак.
Следующая за ней это тоже услышала, скорректировала. И тд
/¯
Где доза?
DB
кодируем колпачки: синий 0, зелёный 1, красный 2. Поддерживаем куммулятивную сумму в кольце F_3.
Первая героиновая шлюха, которая видим всех, называет сумму всех, кого видит. Следующая за ней видит сумму всех, кроме своей: отняла одно от другого, получила свой колпак.
Следующая за ней это тоже услышала, скорректировала. И тд
Первая героиновая шлюха, которая видим всех, называет сумму всех, кого видит. Следующая за ней видит сумму всех, кроме своей: отняла одно от другого, получила свой колпак.
Следующая за ней это тоже услышала, скорректировала. И тд
Зря, дали бы человеку подумать
DB
И, кстати, это не единственное решение, можно аксиому выбора вспомнить и считать количество не эквивалентных позиций в конечном числе размещений
2020 August 23
т
Баллон, содержащий m1 =1 кг азота, при испытании на прочность взо- рвался при температуре t1 = 327 °C . Какую массу водорода m2 можно было бы хра- нить в таком баллоне при температуре t2 = 27 °C , имея пятикратный запас прочности? Молярная масса азота M1 = 28 г/моль, водорода M 2 = 2 г/моль.
pVpVpV
ν1 = 1 1 , ν2 = 2 2 , ν3 = 3 3 .Когдапоршниосвободят,давлениевовсехкамерах RT0 RT0 RT0
1110
(V +V +V )T 1230
Решение. Из уравнения состояния азота следует, что давление, при котором взорвал- m RT
ся баллон, p = 1 1 , где V – объем баллона, T = t + 273 °C . По условию водород 111
M1 V
можно хранить при давлении p2 = p1 / 5. Учитывая, что p2 = m2 RT2 , получаем
m2 = m1 M 2 t1 + 273 °C ≈ 28 г. 5 M1 t2+273°C
Ответ. m2=m1M2t1+273°C≈28г. 5 M1 t2+273°C
я не понимаю логику
pVpVpV
ν1 = 1 1 , ν2 = 2 2 , ν3 = 3 3 .Когдапоршниосвободят,давлениевовсехкамерах RT0 RT0 RT0
1110
(V +V +V )T 1230
Решение. Из уравнения состояния азота следует, что давление, при котором взорвал- m RT
ся баллон, p = 1 1 , где V – объем баллона, T = t + 273 °C . По условию водород 111
M1 V
можно хранить при давлении p2 = p1 / 5. Учитывая, что p2 = m2 RT2 , получаем
m2 = m1 M 2 t1 + 273 °C ≈ 28 г. 5 M1 t2+273°C
Ответ. m2=m1M2t1+273°C≈28г. 5 M1 t2+273°C
я не понимаю логику
т
Баллон, содержащий m1 =1 кг азота, при испытании на прочность взо- рвался при температуре t1 = 327 °C . Какую массу водорода m2 можно было бы хра- нить в таком баллоне при температуре t2 = 27 °C , имея пятикратный запас прочности? Молярная масса азота M1 = 28 г/моль, водорода M 2 = 2 г/моль.
pVpVpV
ν1 = 1 1 , ν2 = 2 2 , ν3 = 3 3 .Когдапоршниосвободят,давлениевовсехкамерах RT0 RT0 RT0
1110
(V +V +V )T 1230
Решение. Из уравнения состояния азота следует, что давление, при котором взорвал- m RT
ся баллон, p = 1 1 , где V – объем баллона, T = t + 273 °C . По условию водород 111
M1 V
можно хранить при давлении p2 = p1 / 5. Учитывая, что p2 = m2 RT2 , получаем
m2 = m1 M 2 t1 + 273 °C ≈ 28 г. 5 M1 t2+273°C
Ответ. m2=m1M2t1+273°C≈28г. 5 M1 t2+273°C
я не понимаю логику
pVpVpV
ν1 = 1 1 , ν2 = 2 2 , ν3 = 3 3 .Когдапоршниосвободят,давлениевовсехкамерах RT0 RT0 RT0
1110
(V +V +V )T 1230
Решение. Из уравнения состояния азота следует, что давление, при котором взорвал- m RT
ся баллон, p = 1 1 , где V – объем баллона, T = t + 273 °C . По условию водород 111
M1 V
можно хранить при давлении p2 = p1 / 5. Учитывая, что p2 = m2 RT2 , получаем
m2 = m1 M 2 t1 + 273 °C ≈ 28 г. 5 M1 t2+273°C
Ответ. m2=m1M2t1+273°C≈28г. 5 M1 t2+273°C
я не понимаю логику
если у баллона с водородом прочность х5, то почему у них допустимое давление в этом баллоне в пять раз меньше, чем в первом
т
наооборот же должно быть?